La réponse est nuancée. « Pouvez-vous utiliser les tests comme un dépistage d’atopie chez tout chien avec des démangeaisons? ». « Non! » Vous devez d’abord passer par le protocole de diagnostic ICADA avant de procéder à des tests d’allergie spécifiques. Cependant: « Pouvez-vous utiliser ces tests pour confirmer l’atopie après que le protocole de diagnostic ICADA ait montré un fort soupçon d’atopie: « Oui« .
Pour recevoir des notifications des résultats sur votre logiciel vétérinaire, vous devez ajuster certaines choses dans vos paramètres sur MyZoolyx.
Vous cliquez d’abord sur My Zoolyx, puis sur votre nom d’utilisateur (‘démo’ dans cette capture d’écran)
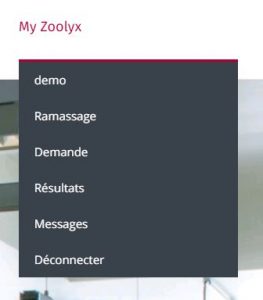
et puis sur « Gérer cabinet » comme sur cette image

Ensuite, vous arrivez à la page suivante. Ici, cochez la case des notifications et sélectionnez votre service de logiciel.

Sur la même page, cliquez sur « modifier » à côté des membres du cabinet qui souhaitent recevoir les rapports. Répétez cela pour chaque vétérinaire qui souhaite recevoir les notifications.
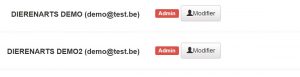
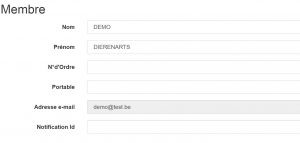
Ensuite, vous arriverez sur cette page où vous devrez remplir la « Notification ID ». Pour Fuga, c’est votre ID Fuga. Vous pouvez demander ce numéro à VETCloud pour leur service.
AMCRA est un centre de connaissances concernant l’utilisation des antibiotiques vétérinaires. L’objectif est de prévenir la résistance aux antibiotiques afin de protéger la santé publique, la santé animale et le bien-être animal. L’AMCRA est composée d’organisations gouvernementales concernées, de représentants de l’industrie pharmaceutique et animale, d’organisations agricoles et vétérinaires. En plus de recueillir et d’analyser des données sur l’utilisation et la résistance des antibiotiques chez les animaux, l’AMCRA organise des campagnes de sensibilisation et donne des conseils pratiques et des lignes directrices sur l’utilisation des antibiotiques vétérinaires.
Les directives tiennent compte de l’importance clinique et la gravité d’une infection bactérienne chez l’animal d’une part et l’importance de l’efficacité d’un antibiotique ou d’une classe d’antibiotiques pour l’utilisation humaine telle que définie par l’Organisation mondiale de la santé (WHO), d’autre part, et, bien sûr, du système de cascade et du cadre juridique en Belgique pour l’utilisation de médicaments chez les animaux producteurs de denrées alimentaires. L’objectif de directives pour les traitements antibactériens est d’encourager une utilisation responsable et avisée des antibiotiques, afin de lutter contre la sélection et la diffusion des résistances antibactériennes. Le vétérinaire est et restera personnellement responsable de la décision d’administrer ou non des antibiotiques, et du choix du produit si une thérapie antibactérienne s’impose.
Certains allergènes répondent mieux à un test d’allergie intradermique (IDAT), tandis que d’autres sont plus clairement déterminés par un test d’allergie sérologique (SAT). Les deux types de tests peuvent donner des résultats faussement négatifs ou faussement positifs. Cependant, la réalisation et l’interprétation de l’IDAT nécessitent davantage de compétences techniques, de connaissances et d’expérience que celles du SAT. En outre, l’IDAT est plus facilement influencé par les traitements médicamenteux.
Codes de couleur AMCRA
Afin d’encourager une utilisation responsable et avisée des antibiotiques, afin de lutter contre la sélection et la diffusion des résistances antibactériennes, l’AMCRA a établi des directives
Le vade-mecum de l’AMCRA répertorie les thérapie antimicrobiennes les plus responsables priorisées par code couleur par espèce et par indication. Le code de couleur, à son tour, est basé sur l’importance de la molécule dans la médecine humaine selon l’Organisation mondiale de la santé (WHO) et fixe les préférences et les conditions suivantes.
| Code couleur | Examen de labo supplémentaire (1)(2) | Test de susceptibilité antibactérienne (1)(2) | Classification WHO |
|---|---|---|---|
| Jaune | Par préférence | Par préférence | Important antimicrobials |
| Orange | Condition | Par préférence | Highly important antimicrobials |
| Rouge | Condition | Condition | Critically important antimicrobials (3) |
(1) Échantillon prélevé avant le début de la thérapie
(2) Si un examen de laboratoire complémentaire et un test de susceptibilité aux antibiotiques sont impossibles ou ne sont pas immédiatement disponibles, il faut justifier le choix thérapeutique du traitement antibactérien, en se basant soit sur des données de la littérature scientifique, soit des données historiques, datant de moins d’un an, relatives aux résultats d’examens de laboratoire complémentaire et/ou des résultats de tests de susceptibilité aux antibiotiques, soit des résultats cliniques. Et à condition que l’activité des antibiotiques jaunes ou oranges ne soit incontestable.
(3) Il s’agit notamment des quinolones et des céphalosporines de troisième, quatrième et cinquième générations à activité systémique. Ces médicaments font partie des classes d’antibiotiques les plus critiques pour la santé publique et doivent donc être administrés avec la plus grande retenue en médecine vétérinaire.
De nouveau, la réponse est nuancée. Il ne sert à rien de répéter des tests d’allergie pour parvenir à un diagnostic. Pour établir le diagnostic, il faut d’abord suivre ponctuellement le protocole de diagnostic ICADA. IIl s’ensuit que la question de savoir si les tests d’allergie (et éventuellement l’immunothérapie) ont un sens ou non.
Il n’est pas nécessaire de répéter les tests pour évaluer le succès de l’immunothérapie.
Bien que les anticorps IgE disparaissent assez rapidement de la circulation, les plasmocytes responsables de leur production le font beaucoup moins, et les cellules B (mémoire) qui se différencient en plasmocytes ne le font certainement pas.
L’évaluation du succès de la thérapie se fait cliniquement : réduction des démangeaisons.
D’autre part, le statut d’allergique n’est pas un fait statique. L’atopie disparaît rarement, voire jamais, mais peut changer de profil au fil du temps. Si un patient a d’abord bien répondu à l’immunothérapie et que, soudainement, il n’y répond plus, il peut être utile de répéter des réactions supplémentaires ou intensifiées.
Une rechute au cours d’une immunothérapie antérieure réussie peut justifier la répétition du test.
En ce qui concerne l’influence des traitements médicamenteux (anti-démangeaisons), il convient de distinguer les tests d’allergie intradermiques (IDAT) et les tests sérologiques d’allergie (SAT).
On peut logiquement s’attendre à ce qu’une réaction allergique cutanée, c’est-à-dire un érythème et des démangeaisons, soit supprimée par les médicaments actuellement disponibles, en particulier lorsque le mécanisme à l’origine de cette réaction est directement bloqué. Théoriquement, en revanche, il y a peu de raisons de penser que les anticorps IgE disparaissent du sang à relativement court terme ou que leur production cesse sous l’influence de ces produits, car aucun d’entre eux n’agit directement sur les IgE.
C’est également ce qu’ont montré toutes les études menées jusqu’à présent sur ce sujet, étant entendu qu’il ne s’agit que d’un petit nombre d’études, que leur portée est limitée et que certaines interactions n’ont pas encore été étudiées du tout. D’autre part, le consensus au sein de la médecine humaine, qui dispose d’un corpus de connaissances plus étendu, est le même: l’IDAT est souvent affectée, le SAT pas ou beaucoup moins.
Tests d’allergie intradermiques
| Produit | Période d’abstinence optimale (jours)1 | Période d’abstinence minimale (jours)2 |
|---|---|---|
| Antihistaminiques (par voie orale) | 7 | 2 |
| Glucocorticoïdes (action à courte durée, par voie orale) | 14 | Inconnu |
| Glucocorticoïdes (injectable, à action prolongée) | Inconnu | 28 |
| Glucocorticoïdes (topiques) | 14 | 0 |
| Ciclosporine (oral) | 0 | 0 |
| Tacrolimus (topique) | 0 | 0 |
| Pentoxifylline (oral) | 0 | 0 |
| Kétoconazole (oral) | 0 | 0 |
| Acides gras essentiels (oral) | 0 | 0 |
L’acépromazine et les dérivés de la morphine ne sont pas recommandés en raison de leur effet de libération d’histamine. Les progestatifs, les agonistes ß2-adrénergiques, les bronchodilatateurs et les antidépresseurs tricycliques sont également mentionnés dans la liste des médicaments à éviter pendant l’IDT, mais ils reposent sur une extrapolation de la médecine humaine ou sur des bases théoriques et non-étudiés chez les chiens.
Tests sérologiques d’allergie
| Produit | Période d’abstinence optimale (jours)1 | Période d’abstinence minimale (jours)2 |
|---|---|---|
| Antihistaminiques (par voie orale) | Inconnu | 0 |
| Glucocorticoïdes (à courte durée d’action, par voie orale) | 0 | 0 |
| Glucocorticoïdes (à action prolongée, par voie parenterale) | <28 | Inconnu |
| Glucocorticoïdes (topiques) | Inconnu | 0 |
| Ciclosporine (oral) | 0 | 0 |
1 Période pendant laquelle aucune interférence du produit sur les résultats du test n’a pu être démontrée par une étude soit être attendue sur la base du mécanisme d’action.
2 Période plus courte pendant laquelle on peut s’attendre à un léger effet inhibiteur au maximum, sans que cela n’affecte l’interprétation des résultats du test.
Conclusion SAT
Références
2020
IgE allergy diagnostics and other relevant tests in allergy, a World Allergy Organization position paper Article de journal
Dans: World Allergy Organ J, vol. 13, no. 2, p. 100080, 2020, ISSN: 1939-4551.
2015
Canine atopic dermatitis: detailed guidelines for diagnosis and allergen identification Article de journal
Dans: BMC Vet Res, vol. 11, p. 196, 2015, ISSN: 1746-6148.
2013
Evidence-based guidelines for anti-allergic drug withdrawal times before allergen-specific intradermal and IgE serological tests in dogs Article de journal
Dans: Vet Dermatol, vol. 24, no. 2, p. 225–e49, 2013, ISSN: 1365-3164.
2011
Histamine and H1-antihistamines: celebrating a century of progress Article de journal
Dans: J Allergy Clin Immunol, vol. 128, no. 6, p. 1139–1150.e4, 2011, ISSN: 1097-6825.
2010
Investigation on the effects of ciclosporin (Atopica) on intradermal test reactivity and allergen-specific immunoglobulin (IgE) serology in atopic dogs Article de journal
Dans: Vet Dermatol, vol. 21, no. 4, p. 393–399, 2010, ISSN: 1365-3164.
2006
Pain management and anesthesia in veterinary dermatology Article de journal
Dans: Vet Clin North Am Small Anim Pract, vol. 36, no. 1, p. 1–14, v, 2006, ISSN: 0195-5616.
2003
The effects of corticosteroid treatment on anti-flea saliva IgE, as measured by intra-dermal skin test and ELISA, in laboratory beagles with experimentally induced flea allergy dermatitis Article de journal
Dans: Vet. Derm, vol. 11, 2003.
2001
The ACVD task force on canine atopic dermatitis (XVII): intradermal testing Article de journal
Dans: Vet Immunol Immunopathol, vol. 81, no. 3-4, p. 289–304, 2001, ISSN: 0165-2427.
1992
The Influence of Oral Corticosteroids or Declining Allergen Exposure on Serologic Allergy Test Results Article de journal
Dans: Veterinary Dermatology, vol. 3, no. 6, p. 237-244, 1992.
Toutes les méthodes sont similaires. La différence réside dans le regroupement ou l’individualisation des allergènes et dans le mode de production des allergènes (recombinants vs purifiés naturels).
Par préférence du sérum, mais un prélèvement EDTA est également possible.
Le tube doit être rempli d’au moins 2 mL. Tout ce qui est inférieur n’a aucun sens pour l’envoi!
- Le prélèvement doit parvenir au laboratoire dans les 5 jours.
- Entre-temps, conservez le prélèvement au réfrigérateur.
- Le prélèvement peut être centrifugé, mais ce n’est pas nécessaire.
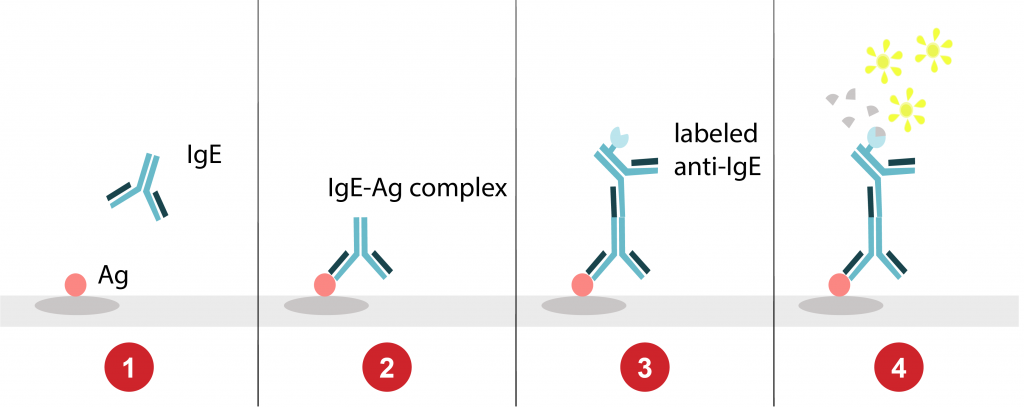
Le sérum/plasma du patient est mis en contact avec les allergènes. Le complexe allergène-IgE-patient est alors reconnu par un anticorps anti-IgE marqué. Après ajout d’un substrat réagissant avec le marqueur, l’intensité de la réaction est mesurée par spectrophotométrie. Le résultat est exprimé en « Elisa Absorbance Units (EAU) ».
Non, ce n’est malheureusement pas possible. D’un point de vue technique, les tests sont conçus comme deux panels distincts, réalisés dans leur intégralité. Il n’existe pas de panel d’extension contenant uniquement ce qui n’est pas dans Immunoscreen 12 mais qui est dans 24.
Seules les valeurs >100 EAU sont significatives.
Cependant, une atopie est peu probable avec une seule réaction faible (par exemple 150 EAU). Dans ce cas, il n’y a pas grand-chose à attendre de l’immunothérapie. Réévaluer le diagnostic et suivre méticuleusement le protocole ICADA.
En cas de réactions positives multiples, il est recommandé de ne prendre en compte que les plus marquantes et d’établir une corrélation entre les résultats et l’anamnèse. Par exemple, une légère réaction au pollen en hiver n’est pas pertinente.
Le résultat du pollen ne donne aucune information sur la sensibilité aux protéines des céréales dans l’alimentation.
Au moins 1 an.
Lorsque les résultats sont satisfaisants, il est recommandé de poursuivre la thérapie pendant au moins 3 ans.
Cela varie d’un patient à l’autre, mais la plupart s’améliorent en l’espace de quelques mois. Les résultats maximaux sont généralement obtenus au bout de 12 mois.
Si le diagnostic est correct, que l’immunothérapie est appliquée correctement et que le succès est défini comme l’arrêt des médicaments conventionnels, on peut s’attendre à un taux de réussite compris entre 65 % et 75 %. (Favrot, ESVD Congres 2022). En association avec des produits de protection de la peau (par exemple, shampooing/mousse à base d’ophytrium), ce taux peut augmenter jusqu’à >80 %.
La valeur Ct est un paramètre technique de RT-qPCR (réaction en chaîne de polymérase quantique en temps réel) qui correspond au nombre de cycles d’amplification requis avant que l’échantillon soit évalué positivement.
Pour mieux comprendre cela, vous devez d’abord savoir ce qu’est RT-qPCR et quelle est la différence avec la PCR conventionnelle.
Si aucun résultat satisfaisant n’a été obtenu avec la dose standard, cela ne sert à rien. Remettre en question le diagnostic (voir le protocole ICADA).
Une augmentation de la dose et/ou un raccourcissement de l’intervalle de traitement doivent être envisagés chez les patients qui ont initialement bien répondu au traitement mais qui ont rechuté. Sachez que les rechutes peuvent également être dues à une modification du profil allergique qui ne sera mise en évidence qu’après un nouveau test allergique.
Les deux techniques utilisent des primers qui détectent un morceau de code génétique caractéristique de ce que l’on recherche dans l’échantillon. La différence avec RT-qPCR est l’utilisation supplémentaire d’une sonde (probe) fluorescente. Cette sonde, également caractéristique pour le code recherché, se lie un peu loin des primers.
La pièce manquante entre les primers et la sonde est complétée par la polymérase Taq. Au moment où la chaîne est entièrement copiée, la sonde libère son label fluorescente.
À la fin du cycle, une copie est produite qui est utilisée ensemble avec l’original dans le cycle suivant pour les copier à nouveau. Comme le nombre de copies double au cours de cycles successifs, la fluorescence augmente de façon exponentielle.
Cependant, à mesure que les cycles progressent, les réactifs sont épuisés et constituent un facteur limitant pour l’augmentation exponentielle, l’augmentation de la fluorescence ralentit et cela de plus en plus rapide.
R&ndy l’explique aussi en détail dans ce film.
Si le résultat est satisfaisant, il n’est pas nécessaire de répéter le test.
En l’absence de résultat positif, il faut d’abord s’interroger sur le diagnostic (voir le protocole ICADA).
En cas de rechute du patient après une bonne réponse, il peut être utile de répéter le traitement. Voir aussi « Est-il utile de répéter les tests d’allergie? »
Oui. Au fil du temps, le paramètre a reçu de nombreux noms
- Ct: threshold cycle
- Cq: quantification cycle
- Cp: crossing point
- TOP: take-off point
Pendant le traitement, un gonflement du site d’injection peut survenir, accompagné ou non de démangeaisons. Dans de rares cas, un choc anaphylactique peut se produire.
À la fin de l’analyse, nous verrons une courbe de réaction en forme de S. La courbe réactive d’un contrôle positif est utilisée pour déterminer le point de départ de l’augmentation exponentielle. C’est ce qu’on appelle le threshold. Le cycle dans lequel un échantillon positif dépasse le threshold est la valeur Ct de l’échantillon.
En plus du résultat, vous pouvez également trouver une ordonnance pour chaque test positif via myZoolyx. Cet ordonance propose une composition du fluide hyposensibilisant.
Envoyez ce formulaire complété à biogenix.be@ceva.com. Pas à Zoolyx!
Moins il faut de cycles pour dépasser le threshold, plus il y a de ce qui est recherché dans l’échantillon dès le départ. Un peu contre-intuitif, mais plus la valeur sera basse, plus l’échantillon sera considéré comme positif !
La prescription vous permet de commencer, mais n’est qu’une suggestion. Il peut être ajusté en fonction des informations révélées par l’anamnèse et de la mesure dans laquelle les allergènes peuvent être évités (régime alimentaire, traitement contre les puces,…). Suivez les règles empiriques suivantes :
- des puces: non, mais des acariens: oui
- pas d’allergènes évitables (puces, allergènes alimentaires)
- plutôt moins (éventuellement réparti sur plusieurs thérapies) que tous les allergènes à la fois
- les allergènes réagissant le plus fortement en premier, les allergènes réagissant faiblement n’étant vraisemblablement pas pertinents
- quoi qu’il en soit, maximum 5
Bien qu’il soit présenté comme un monde numérique – positif/négatif, le morceau ADN/ARN est présent ou non – il n’est pas si numérique du tout. Il y a toujours du bruit en arrière-plan, c’est-à-dire qu’il y a toujours un signal (faible) qui n’a rien à voir avec ce qui est recherché. C’est le cas de toute technique de mesure, et avec la PCR, c’est le résultat d’une liaison non spécifique des primers et de la sonde.
Avec la PCR, ce phénomène n’est pas sans conséquence . Après tout, il s’agit d’une technique d’amplification, une méthode de mesure qui amplifie systématiquement le signal. Pas simplement amplifié, mais exponentiellement amplifié. Si on amplifie assez longtemps (augmenter le nombre de cycles), le signal de bruit dépassera le threshold et donc l’echantillon semblera positif.
C’est pourquoi nous nous arrêtons (par convention) à 40 cycles à quel moment l’echantillon est considéré comme négatif.
Les allergènes sont répartis en concentration égale. Moins il y a d’allergènes dans le mélange, plus ils seront concentrés. Il est possible de concentrer un certain allergène plus haut s’il est certain que cet allergène est en grande partie responsable des plaintes. Dans la pratique, cependant, cette possibilité est rarement utilisé.
Il est attesté que le liquide a une durée de conservation d’au moins un an après la date de production. Cependant, les allergènes sont des molécules très stables, 1 an 1/2 est réaliste.
À partir de ce qui précède, nous avons appris que comparer les valeurs Ct entre laboratoires n’est pas possible. Alors peut-on comparer des patients avec la même maladie? Aussi difficile. Alors, un patient peut-il être suivi en utilisant la valeur Ct?
De nouveau, pas sans nuance.
Comme indiqué précédemment, le prélèvement est critique. Lorsque les valeurs Ct sont suivies dans le temps à l’aide d’échantillons prélevés par écouvillonnage, cette comparaison n’est pas évidente. C’est vrai, la durrée, la position, le profondeur d’echantillonage, … tout compte.
Dans le cas de sang, cela est beaucoup moins important. Nous pouvons supposer sans risque que le sang est un mélange assez homogène et que la méthode d’échantillonnage a beaucoup moins d’influence sur le résultat.
Il y a aussi un côté plus philosophique à l’attitude qu’on devrait adopter pendant la surveillance, et cela en général. La surveillance signifie avant tout “observation”. Une seule valeur aberrante en haut ou en bas doit être remarquée et vérifiée, mais sans tirer de conclusions prématurées et sans apporter automatiquement de changements au traitement. C’est la tendance au fil du temps sur de nombreux points de mesure qui indique d’où va-t-il aller, pas le dernier point de mesure et certainement pas si vous avez seulement deux.
2 à 3 semaines après réception de la commande.
L’immunothérapie allergénique est contre-indiqué
- en combinaison avec des anti-inflammatoires puissants, tels que les corticostéroïdes;
- en cas de l’hypersensibilité au phénol (fluide auxiliaire);
- dans des conditions immunologiques (immunodéficience, maladies auto-immunes);
- dans des conditions générales sévères.
Non.
Les maladies infectieuses sont des processus complexes dans lesquels des caractéristiques du pathogène jouent un rôle importent (type de germe, présence et activation des facteurs de virulence, et la dose d’infection) à côté des traits de son hôte(l’âge, l’immunité, des comorbidités, la prédisposition génétique,…lorsque tout ce qui précède a également une influence sur l’autre). Certains pathogènes conduisent presque toujours à la maladie, d’autres dans certaines circonstances, parfois seulement quelques particules sont suffisantes, parfois il faut de millions. Donc non, il est inutile de comparer des valeurs Ct entre des germes.
Qu’en est-il d’une maladie infectieuse particulière dont les caractéristiques et le rôle des facteurs hôtes sont plus ou moins connus (p. ex., la COVID chez les humains, l’herpès chez les chevaux, etc.)?
De nouveau, pour effectuer le point de comparaison tous les facteurs pouvant provoquer une variation de la valeur Ct en dehors du patient doivent être désactivés (même technique de prélèvement, même laboratoire, même méthode d’analyse, …). Deuxièmement, il faut également avoir une idée claire dustade du processus de la maladie. Il y aura très peu de particules infectieuses au début et à la fin d’une infection. Dans les deux cas, la valeur Ct peut être la même. De plus, un échantillon n’est représentatif que du moment où il est prélevé, quelques heures plus tard le résultat peut être différent.
Prétendre qu’un patient avec une valeur Ct élevée est moins contagieux qu’un patient avec une valeur faible n’est qu’une demi-vérité. Au moment du prélèvement, cela peut être vrai. Mais le lendemain, par exemple, ce n’est plus le cas.
Il n’existe pas de données connues sur l’immunothérapie en combinaison avec la gestation. Il n’est donc pas recommandé.
Non, il est contre-indiqué de défier le système immunitaire sur plusieurs fronts à la fois.
Attendez au moins une semaine entre ces deux types de traitement.
Pour chaque dossier, des frais de gestion sont ajoutés à la facture. Il s’agit de tous les coûts qui ne sont pas directement liés à une analyse spécifiquetels que le traitement administratif, le ramassage, la logistique et les frais d’expédition,…
Ces frais sont facturés au maximum une fois par jour et par patient. Si nous recevons plusieurs prélèvements du même patient en même temps, ces frais ne seront facturés qu’une seule fois.
Sur la page de votre rapport, vous pourrez également voir le prix de ces enquêtes. Ceci est juste pour votre information. Il n’est pas possible de régler ce solde en ligne. Une fois tous les examens terminés, la facture est préparée et envoyée par la poste.
Sur la facture que vous avez reçue de Zoolyx, vous trouverez tous les détails pour effectuer le paiement. Dans la case en haut à gauche, vous trouverez notre IBAN, le BIC de notre banque et notre numéro de TVA.
IBAN: BE 69 3631 3257 3778
BIC: BBRUBEBB
TVA: BE0549.932.689
Pour que votre paiement soit enregistré correctement, vous devez également joindre un message structuré à votre paiement. Vous le trouverez dans la case grise avec le montant à payer.
Zoolyx est un laboratoire de diagnostic vétérinaire. Les vétérinaires et les cabinets vétérinaires nous demandent de collecter et d’analyser des échantillons pour les aider dans le diagnostic et le suivi de leurs patients. Si vous avez reçu une facture de notre part, c’est probablement parce que nous avons reçu vos coordonnées ainsi qu’un échantillon de votre vétérinaire.
Pour toute question relative aux résultats ou à leur interprétation, veuillez contacter votre vétérinaire.
Si vous avez reçu une facture contenant des données incorrectes ou manquantes, veuillez en informer facturation@zoolyx.be dans les deux mois suivant la date de la facture originale et vous recevrez une version corrigée..
Vous avez reçu une facture parce que nous avons effectué une analyse à la demande de votre vétérinaire. Bien entendu, vous aurez également accès aux résultats.
Si nous avons également reçu votre adresse électronique du vétérinaire, vous pouvez vous connecter à notre site web zoolyx.be pour accéder à vos résultats.
Si nous n’avons pas reçu votre adresse électronique, vous pouvez demander au vétérinaire demandeur de vous communiquer les résultats.
Het resultaat van een antibiogram bestaat uit een lettercode en vaak ook een getalwaarde afhankelijk van met welke methode het antibiogram bepaald werd.
De lettercode
Dit is de interpretatie die gegeven wordt aan de gemeten zonediameter (diskdiffusiemethode) dan wel de gemeten MIC (microdilutiemethode). Daarnaast wordt ook rekening gehouden met de geïsoleerde bacteriesoort of type, de uitkomst van bijkomende testen (*), de diersoort en de oorsprong van het staal. Er zijn drie mogelijke uitkomsten:
| S | Sensible | La souche bactérienne est sensible à l’antibiotique si elle est administrée à la dose prescrite dans la notice. |
|---|---|---|
| I | Intermédiaire | Cela ne signifie pas que l’antibiotique ne fonctionne pas du tout mais qu’il ne fonctionne pas aussi bien. Cela peut être compensé par un traitement prolongé et/ou un dosage élevé en respectant les exigences de sécurité du fabricant. |
| R | Résistent | La souche bactérienne n’est pas sensible à l’antibiotique et est exclue comme choix thérapeutique. |
(*) Parfois, le simple contact de l’isolat avec un antibiotique n’est pas suffisant pour déterminer son efficacité dans le délai de l’essai. Le profil de résistance peut changer lorsque certains facteurs de résistance sont présents et n’entrent en vigueur que plus tard et doivent donc être testés spécifiquement (par ex. ICL et ESBL).
La valeur numérique
Cette valeur ne peut être rapporté qu’à l’aide de la méthode de microdilution. Cette méthode n’est pas disponible pour toutes les combinaisons bactéries-antibiotiques.
Afin de déterminer l’efficacité, la souche bactérienne isolée est suspendue avec une série de dilution de l’antibiotique. La dilution de l’antibiotique la plus elevée (et donc la concentration la plus faible) dans lequel la croissance bactérienne est complètement supprimée est une approche de la concentration minimale inhibitoire (CMI) exprimée en µg/mL.
Cette valeur est à considérer comme une information supplémentaire et dont le code alphabétique est un interprétation.
- Ça donne une idée de la sensibilité (ou résistance) de la bactérie en terme quantitatif.
- Plus la valeur est faible, plus élevée la concentration nécessaire de l’antibiotique pour tuer la bactérie.
- Entre deux dilutions il y a un facteur de 2, la CMI réelle (mesurée sur une échelle continue) est donc entre la dilution rapportée et une étape plus concentrée (moins diluée);
- En théorie, la CMI réflète la concentration tissulaire minimale dans le tissu à traiter. Pour une estimation plus ou moins calculée, il faut des données pharmacocinétiques et dynamiques; sans parler de l’mpact du biofilm et du pus;
- La comparaison des valeurs CMI entre différents antibiotiques n’a aucune signification clinique.
Lié au sexe – Autosomique
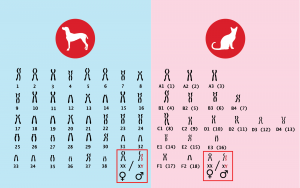
Si un gène est situé sur un chromosome sexuel (X ou Y), on parle de trait lié au sexe. S’il est situé sur l’un des nombreux autres chromosomes, on parle de trait autosomique. La grande majorité des traits sont autosomiques. Les traits liés au sexe chez les mammifères sont principalement liés au chromosome X, seuls quelques-uns sont liés au chromosome Y. Un trait autosomique est exprimé de manière égale dans les deux sexes. Un trait lié au chromosome X se comporte chez les individus de sexe féminin comme un trait autosomique, puisqu’elles possèdent deux chromosomes X. Dans ce cas, une variante peut être partiellement ou totalement compensée par une autre variante sur l’autre chromosome X. Les individus de sexe masculin, en revanche, n’ont qu’un seul chromosome X. Une variante ou un défaut s’y exprimera toujours. Par ailleurs, un trait lié au chromosome Y ne peut s’exprimer que chez les individus mâles, les femelles n’ayant pas de chromosome Y. Ce dernier point est quelque peu théorique: aucun trait lié à l’Y ayant une utilité pratique (c’est-à-dire pouvant être testé) n’est actuellement connu chez nos animaux de compagnie.
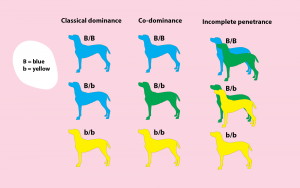
Dominant – Co-dominant – Récessif
Une deuxième distinction reflète la mesure dans laquelle une caractéristique est exprimée. Il suffit que la variante soit présente sur l’un ou l’autre gène pour qu’elle soit dominante. Si la variante ne s’exprime que lorsque les deux gènes sont porteurs de la variante, celle-ci est récessive. Une troisième possibilité est que la variante ne soit que partiellement exprimée. Il existe alors trois formes: celle où le trait est pleinement exprimé parce que les deux gènes portent la variante, celle où il n’est pas exprimé simplement parce que la variante n’est pas présente, et celle qui se situe entre les deux, où seul l’un des gènes présente la variante. Dans ce cas, on parle de codominance ou de dominance partielle. Les traits liés à l’X (et à l’Y) sont toujours dominants chez les individus de sexe masculin.
Pénétrance
La présence d’un variant ne garantit pas toujours son expression phénotypique, même lorsqu’il est dominant ou, dans le cas de la récessivité, présent sur les deux gènes. Dans ce cas, on parle de pénétrance incomplète d’une variante. Cela ne se produit pas pour tous les défauts ou traits génétiques, mais peut expliquer pourquoi la génétique n’est pas toujours une mathématique exacte, bien qu’elle soit parfois présentée comme telle. Plusieurs mécanismes expliquent ce phénomène:
- plusieurs gènes (polygéniques) déterminent le phénotype, un gène pouvant influencer, voire annuler l’effet d’un autre;
- le génotype ne s’exprime lorsque certains facteurs environnementaux (mode de vie, alimentation, stress…) interviennent et/ou à un certain âge;
- le génotype est activé ou désactivé en fonction des conditions (régulation épigénétique) vécues par l’individu lui-même ou ses ancêtres. Ainsi, une préférence préprogrammée pour l’activation de l’allèle paternel ou maternel, ou vice versa, peut également apparaître (empreinte génomique).
La biobliothèque génétique de chaque individu est organisé en deux séries de chromosomes: l’une provenant du père, l’autre de la mère. Tous les chromosomes ont un homologue dans l’autre série. Par homologue, on entend qu’il s’agit d’une copie fonctionnelle, c’est-à-dire qu’ils possèdent les mêmes gènes (à l’exception du chromosome Y), mais pas d’une copie exacte. Au sein d’une même espèce, il existe souvent deux variantes ou plus d’un même gène. Par exemple, la variante du gène sur le chromosome du père peut être différente de la variante du gène de la mère. Une telle variante est également appelée allèle. Chaque individu possède donc deux allèles pour chaque gène. Ceux-ci peuvent être identiques, homozygotes, ou différents, hétérozygotes. Le génotype est une description (codée) des variantes présentes dans les deux gènes. Par exemple, A/A ou a/a ou A/a.
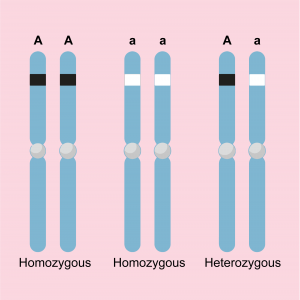
Représentation schématique de deux chromosomes homologues contenant un gène avec deux allèles possibles et donc trois génotypes possibles : A/A, a/a (tous deux homozygotes) et A/a (hétérozygote).
Le phénotype, quant à lui, est une description (verbale) du trait tel qu’il est observé chez l’individu; par exemple, noir, brun, jaune… Plusieurs génotypes peuvent conduire au même phénotype et vice versa. Le phénotype peut souvent être déduit du génotype; inversement, on a parfois besoin du phénotype pour déterminer le génotype avec plus de précision. C’est par exemple le cas lorsqu’un phénotype est contrôlé par plusieurs gènes, mais que ceux-ci ne sont pas tous connus au niveau de l’ADN et ne peuvent donc pas être testés.
Un exemple permet d’y voir plus clair
Les trois couleurs principales du pelage des labradors sont le jaune, le brun (chocolat) et le noir (il en existe d’autres, mais pour ne pas trop compliquer les choses, nous nous arrêterons là). Le phénotype de la couleur de la robe est contrôlé par deux gènes ou loci (singulier: locus) à transmission dominante/récessive classique : le locus B et le locus E. Ces deux loci ont chacun deux allèles possibles, respectivement B soit b, et E soit e. Le locus B détermine si le pigment formé est noir (B) ou brun (b), tandis que le locus E active (E) ou désactive (e) le locus B. Il en résulte 9 génotypes possibles:
 |
E/B | BB | Bb | bb |
| EE | BBEE | BbEE | bbEE | |
| Ee | BBEe | BbEe | bbEe | |
| ee | BBee | Bbee | bbee |
Le tableau permet de déduire que tous les Labradors jaunes sont « fixés » pour le locus E avec l’allèle e. Dans ce cas, vous pouvez donc déduire le génotype du locus E (ee) du phénotype (jaune).
Théoriquement, après 40 cycles, 1 morceau de code génétique était présent au départ de l’analyse a produit 240 ou environ mille milliards (1.099.511.627.776 pour être exact) copies.
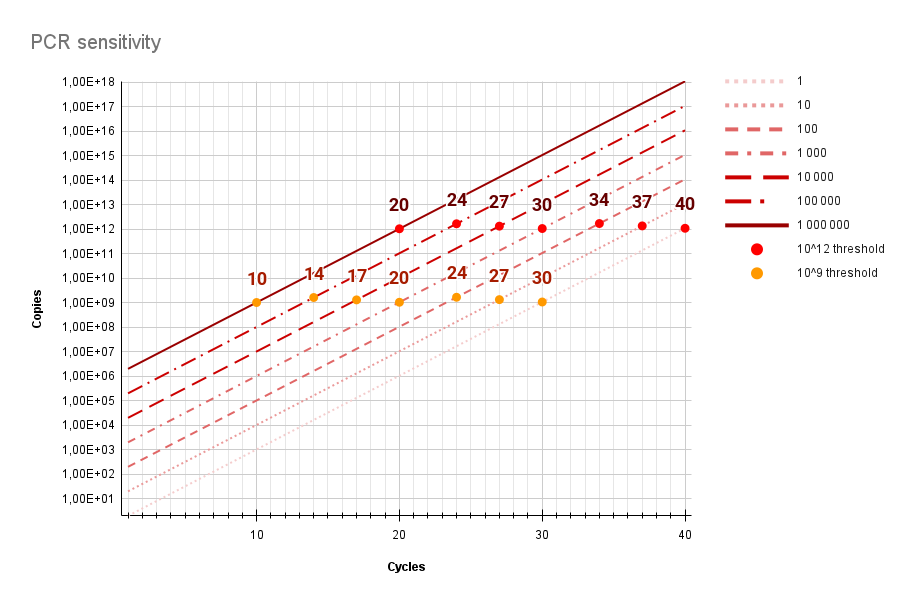
Dans le graphique ci-dessous montre l’évolution du cycle (Ct) où il y avait initialement 1, 10, 100, 1.000, 10.000, 100.000 et 1.000.000 particules présentes dans le’échantillon, et ceci quand on met le seuil (threshold) à 1012copies (rouge) ou à 109 copies (orange).
Notez bien que le patient n’est pas analysé en entier, mais qu’un échantillon prélevé, transporté et conservé dans les meilleures conditions en attendant l’analyse.
Tout l’échantillon n’est pas analysé, mais seulement une toute petite fraction. De cette fraction, le matériel génétique est extrait dans son intégralité. Ce pré-traitement n’est pas 100% efficace, une partie est toujours perdue.
Enfin, seule une fraction du matériel génétique extrait est ajoutée aux réactifs (le master mix) pour initialiser la réaction.
Le graphique présume une efficacité de réaction de 100%, chaque cycle conduit exactement à un doublement. En réalité, c’est un peu moins.
En d’autres termes, au cours des manipulations du patient au tube à essai beaucoup de matériel est perdu ou non utilisé. La sensibilité pour détecter 1 à 10 particules n’est pas excessive car 1 particule dans le tube à essai peut signifier un multiple chez le patient.
La question: “Y a-t-il un lien entre la valeur CT et le nombre de particules infectieuses présentes chez le patient?” elle n’est donc pas si simple à répondre. En théorie, on pouvait compter en arrière, mais le résultat dépend fortement de la qualité de l’échantillon, de l’efficacité de l’extraction du matériel génétique et de l’efficacité de la réaction PCR. Aucun de ceux-ci n’est à 100%.
Non.
Une méthode normalisée (c.-à-d. la même méthode d’extraction, les mêmes réactifs, le même cycle de réaction) devrait théoriquement produire environ la même valeur Ct.
Ce n’est presque jamais le cas. Non seulement il y a toujours des différences techniques (autres réactifs, autre équipement, autre protocole d’amplification, autre méthode d’extraction), la valeur Ct est seulement aussi fiable que le prélèvement. Le prélèvement, le transport et la méthode de conservation (la phase pré-analytique) peuvent faire toute la différence.
Un échantillon incorrect ou de moindre qualité obtiendra bien sûr un score plus élevé ou négatif par rapport à un échantillon correctement prélevé. Idem pour un échantillon mal conservé ou agé. Il est souvent difficile d’obtenir un échantillon identique. Deux échantillons de sang prélevés en même temps devraient avoir un contenu identique. De deux écouvillons, c’est beaucoup moins évident. Un peu plus profond, un peu plus à gauche ou à droite peut produire un rendement significativement différent.
En laboratoire on peut comparer les valeurs Ct par example pour évaluer le rendement des méthodes d’extraction differentes, l’efficacité des combinaisons primers-sondes, protocoles PCR, etc.
Si vous soumettez un prélèvement pour analyse en utilisant votre adresse e-mail, un compte sera créé automatiquement. Vous recevrez un message par e-mail pour activer le compte et mettre un mot de passe. Si vous faites cela en tant que vétérinaire, vous aurez un accès immédiat à toutes les fonctions vétérinaires.
Vous pouvez également vous inscrire en utilisant le menu myZoolyx > Se connecter > Enregistrer. Ensuite suivez ces étapes.
- Entrez votre adresse email.
- Attendez l’e-mail d’activation (regardez aussi dans spam s’il attend depuis plus d’une minute)
- Cliquez sur le lien ou le bouton d’activation dans le mail.
- Mettez un mot de passe. Lorsque vous tapez, le niveau de sécurité du mot de passe est indiqué. Tant que cela ne suffit pas, vous ne pouvez pas l’enrégistrer.
- Répétez le mot de passe et enregistrez.
- Connectez-vous et completez vos coordonnées.
- (vétérinaire seulement) Entrez votre numéro NGROD (nl) ou CRFOMV (fr).
- (vétérinaire seulement) Lorsque nous aurons vérifié votre enrégistrement en tant que vétérinaire, vous recevrez un email de confirmation. A partire de là, vous pouvez accéder à toutes les fonctions vétérinaires.
Vous trouverez les formulaires de demande dans les Outils wikilab.
Egalement les listes de prix y sont disponibles. Ces listes ne sont mises à jour qu’une fois par an, une modification ou une correction provisoire est possible. Vous trouverez le prix le plus récent sur la page wikilab.
Vous pouvez suivre le colis via track.bpost.be. Entrez sur ce site le code dans l’e-mail que vous avez reçu.
Si la recherche ne produit pas de résultat ou si le colis reste dans un certain statut pendant plus de 5 jours, veuillez nous contacter en indiquant le numéro de dossier ou le code dans l’e-mail..
Pour les meilleurs résultats il est recommandé de ne pas nourrir ni abreuver les animaux 30 minutes avant le prélèvement.
- Prennez un animal à la fois.
- Faites tourner l’écouvillon pendant 30 sec sur une place qui se remplit de salive de façon naturelle: la muqueuse de la joue ou sous la langue. Empêchez que l’animal ne morde ou mâche l’éponge.
- Dévissez le bouchon du tube sans renverser le liquide, et mettez le baton dans la tube sans toucher l’extrémité. Puis brisez-le au niveau du point de cassure en pliant puis tournant le baton.
- Jetez la pièce casée. Revissez le bouchon fermement sur le tube, ne pas agiter.
- Collez une étiquette codebar de la micropuce sur le formulaire et marquez le numéro de série ou micropuce sur le tube. Si plusieurs nichées sont prélevées en même temps, marquez égallement la nichée.
- Demandez un assistant de tenir l’animal. La procédure n’est pas douloureuse pour l’animal, mais les animaux anxieux peuvent toujours être effrayés.
- Tournez un doigt autour des quelques poils de la crinière et tirez-le rapidement et puissamment.
- Les racines des poils sont visibles sous forme de points blancs à la base de la tige. Ne touchez pas.
- Mettre les poils dans un sachet plastique avec fermeture zip et sceller.
- Mettez un identifiant sur le sachet.
![]()
Pour les meilleurs résultats il est recommandé de ne pas nourrir ni abreuver les animaux 30 minutes avant le prélèvement.
- Désemballez l’écouvillon. Laissez la partie éponge bien attachée au tube.
- Faites tourner l’écouvillon pendant 30 sec sur une place qui se remplit de salive de façon naturelle: la muqueuse de la joue ou sous la langue. Empêchez que l’animal ne morde ou mâche l’éponge.
- Dévissez l’éponge du tube sans renverser le liquide, et vissez la inversement de sorte que l’éponge repose dans le liquide. Serrez bien.
- Retournez le tube 10x, ne pas agiter.
| v. auricularis | v. jugularis | v. cephalica | v.femoralis* | v. saphena | v. caudalis | v. cava | |
|---|---|---|---|---|---|---|---|
| Taille aiguille (G) Volume syringe (mL) |
21-26 1.0-3.0 |
25-27 1.0-3.0 |
25-27 0.5-1.0 |
23-27 1.0-3.0 |
22-30 0.5-1.0 |
22-27 0.3-1.0 |
25-27 1.0-3.0 |
| Chinchilla (Chinchilla lanigera) |
+ | + | + | + | +/- | ||
| Furet (Mustela putorius furo) |
++ | + | + | ++ | |||
| Gerbille (Meriones unguiculatus) |
+ | + (latérale) | |||||
| Cochon d’Inde (Cavia porcellus) |
+ | ++ | + | +/- | |||
| Hamster | + | + | ++ | + | +/- | ||
| Hérisson (Atelerix albiventris) |
+ | + | + | + | +/- | ||
| Souris (Mus musculus) |
+ | ++ | + | +(latérale) | |||
| Lapin (Oryctolagus cuniculus) |
+ of +/- | ++ | + | ++ | +/- | ||
| Rat (Rattus norvegicus) |
+ | + | ++ | + | + (latérale ou dorsale) | +/- | |
| Phalanger volant (Petaurus breviceps) |
+ | + | + | + | + (ventraal) | ++ |
* La veine fémorale est préférée, mais au lieu l’artère fémorale peut être utilisée compte tenu de la proximité des deux vaisseaux sanguins.
++ Ces vaisseaux sanguins sont utilisés le plus fréquemment et/ou sont préférés pour des volumes de prélèvement plus importants.
+ Solution intermédiaire, pour usage intermédiaire ou modéré.
+/- A utiliser en dernier recours.
Pour des raisons de confidentialité et de déontologie, les rapports d’analyse sont uniquement envoyés à:
- le vétérinaire demandeur ou l’expéditeur des échantillons
- le propriétaire de l’animal au moment de la demande
- toutes adresses e-mail en cc au moment de la demande
Une tierce partie non impliquée dans la demande initiale ne peut pas recevoir une copie en direct, mais seulement par l’intermédiaire du vétérinaire ou du propriétaire d’origine.
En tout cas nous conserveront le droit de demander le paiement préalable des analyses effectuées ou à effectuer.
